質量分析装置Autoflex Speedによるペプチド・マス・フィンガープリンティング(Peptide MassFingerprinting; PMF)その2。三日目です。
Trypsin消化後のペプチドを脱塩・濃縮し質量分析を行い、元のタンパクを同定します。
試薬類
- ペプチド測定用マトリックス α-Cyano-4-hydroxycinnamic acid(HCAA) Sigma-Aldrich #C2020 (マトリックスは施設で実費でお分けしています)
- キャリブレーションスタンダード
Peptide calibration standard Bruker #206195 - トリフルオロ酢酸
Trifluoroacetic Acid 和光 206-10736 - アセトニトリル
Acetonitrile 和光 019-08631
器具等
- ZipTip C18 ミリポア ZTC18S008
- MTP 384 target plate ground steel TF Bruker #209519
- 遠心エバポレータ CVE-2000 or VC-96N
- シェーカー Iwaki TWIN3-28N (3階廊下にあります)
- その他、ピペットおよびチビタンなどマイクロチューブ用遠心機
酵素反応後の抽出と濃縮
- インキュベーターから取り出し、軽くflashしてから抽出液を50μl加え、30分間シェーカーで振とう。
- 抽出液をさらに50μl加え、30分間シェーカーで振とう。
- 上清を別のチューブに回収
- 遠心エバポレーターで10μl程度になるまで濃縮する。
● 抽出液(要時調整)
250μl ACN
25μl TFA
225μl ミリQ水
3階共同利用実験室のCVE-2000で約45分くらい。飛ばしすぎてもマズいので、30分を超えたあたりから10分毎に機械を止めて量を確認した方が無難です(一度カラカラにしてしまいました…)。
脱塩
- 試薬の調整
- ZipTipをピペットに装着し、10μlにセット
- 前処理液をゆっくりゆっくり吸引し、廃液入れにゆっくりゆっくり排出。この操作を5回繰り返す。
- 平衡化液をゆっくりゆっくり吸引し、廃液入れにゆっくりゆっくり排出。この操作を5回繰り返す。
- サンプルをゆっくりゆっくり5回ピペッティングして、レジンに吸着させる
- 洗浄液をゆっくりゆっくり吸引し、廃液入れにゆっくりゆっくり排出。この操作を5回繰り返す。
- ピペットを3μlにセット
- 溶出液をゆっくりゆっくり吸引し、別の新しいチューブに排出。そのまま5回程度ピペッティング。
● 前処理液(100% TFA)
500μl ACN
● 平衡化液(0.1% TFA) 100μl残して洗浄液に
1μl TFA
999μl ミリQ水
● 洗浄液(0.1% TFA)
平衡化液を流用。サンプル当り100μlに分注しておくと良い
● 溶出液(50% ACN, 0.1% TFA)
1μl TFA
500μl ACN
499μl ミリQ水
溶出液もサンプル当り100μlに分注しておくと良い
溶出液が無くなってしまった場合は、慌てずにさらに3μl追加しても大丈夫。
すぐ測定しないのであれば4℃保存のこと(微量なのでできるだけ早く測定した方が良いです)。
測定
- キャリブレーションスタンダードを溶かしておく。
- マトリックス溶液の調整 [TA] 400μl 0.1% TFA
- サンプルおよびキャリブレーションスタンダードをそれぞれ1:4の比率でマトリックス溶液と混合したものを調整。(ピペッティングにより混合)
- 1μlずつターゲットプレートに載せて風乾後Autoflexで測定
200μl ACN
マイクロスパーテル1杯分のHCAAをチューブに取り、500μlのTAを加えてボルテックス(飽和溶液のため完全には溶けない)。
チビタン等でFlashして上清を別のチューブに移す。
結果
今回調整したBSAの結果はこのような具合でした。
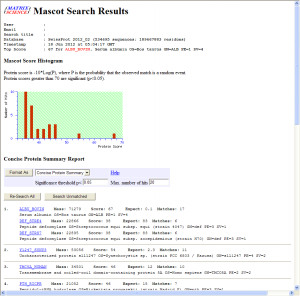
Mascotサーチの結果、無事に同定されているようです。
ほとんど手袋を着用しなかったりなど、かなりラフに実験したこともあり、Mascotのスコアはこんなものかなって感じです。
ちなみに、ZipTipを使わないで、EASY-nLCを使ったLC-MALDIで同じサンプルを測定すると、こんな感じに。
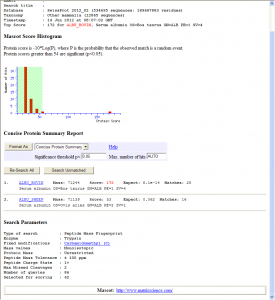
スコアはZipTipの67に対して172まで上がります。
以上がMALDI-TOFによるPMF解析の流れとなります。
実際に研究しているタンパク質やペプチドでは、なかなかこのようにウマくいかないこともあるかもしれませんが、困ったこととかあればいつでも気軽に聞いて下さい。





Leave a Reply