Countess II FL Countess IIについては下記のページを参照下さい。
自動セルカウンター Countess II FL Countess II
● 1. 本体後ろ側に電源があるので電源を入れます。
*数秒で画面が立ち上がります。

● 2. Insert slideの画面になったら使用可能です。
*Insert slide画面の左にDefaultが、右に設定のマークがあります。
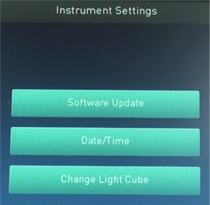
【設定】
・Software Update、Date/Time、Change Light Cubeの3つがあります。
*上の2つは基本的に触る必要はありません。
・Software Updateについては、Updateがあった際に、データを入れたUSBを刺した上でボタンを押します。
・Light Cubeを挿す場合は、Change Light Cubeを押す必要があります。
【Default】
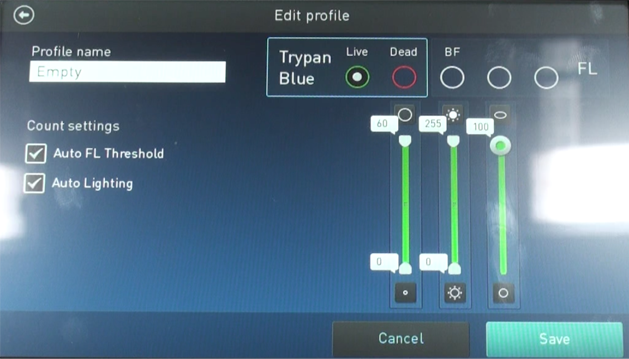
・プロトコルを保存できる画面になります。
・基本的には選んでLoadになりますが、Editを押すと名前やCount setting(蛍光の機能を使用する際のみ)等を設定できます。
*Auto FL Threshhold – 蛍光のThresh holdを自動で引く
*Auto Lighting – 自動で明るさを設定する
・Trypan Blueの場合、右の設定において、LiveまたはDeadのセルサイズ / 輝度 / サーキュラリティ(丸さ)を設定できます。
・これらは事前に設定し、呼び起こして使用できます。
・蛍光を使用する場合は、自動的にFLの項目が増えて、同様の設定が可能になります。
● 3. ディスポーザブルスライドを用意します。
★ 施設で1枚から分譲しています。価格については、施設までお問い合わせ下さい。現在分譲は中止しています。
・A面とB面があり、1スライドで2面まで使用できます。
*文字が正しく読めるほうが正面です。
・表面に半月状のくぼみがあり、こちらに10µlずつ細胞の懸濁液を入れます。
・トリパンブルーの場合には、5µlの細胞懸濁液と5µlのトリパンブルーを混ぜて注入します。
● 4. ディスポーザブルスライドを装置に挿します。
*ある程度は自動でフォーカスされます。
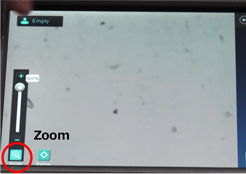
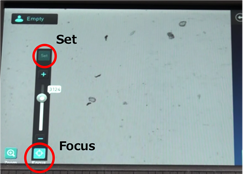
● 5. オートフォーカスのピントが不十分であった場合は、以下のようにします。
・Zoom(デジタルズーム)で4倍まで拡大できますので、拡大した状態にします。
・Focusのプラスマイナスでピントを合わせます。
*Setを押すと、抜き差ししてもSetしたFocusの値に戻ります。
(同じ細胞を続けてカウントする場合などに利用)
● 6. [画像撮影時の明るさ]
明るさが気になる場合は、Light sourceで明るさを調整します。
*トリパンブルーを入れた状態で、5~10が適切です。
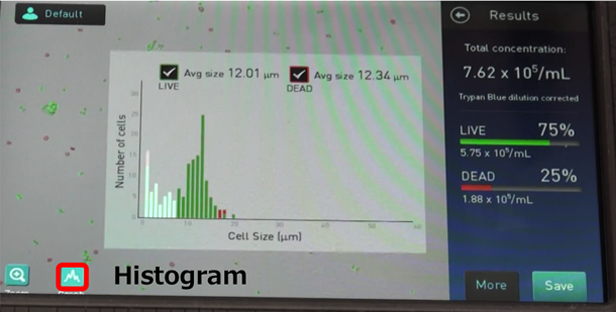
● 7. [結果]
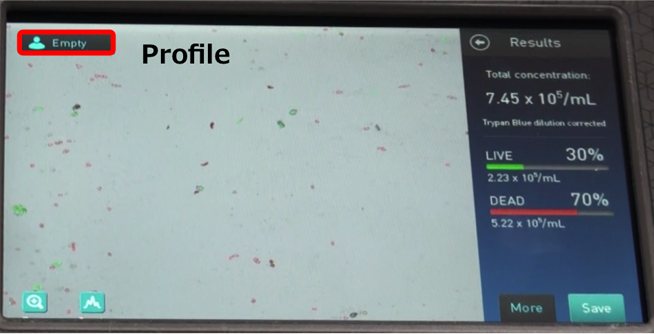
Captureを押すと画像解析した結果が表示されます。
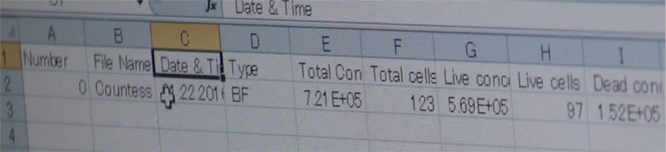
・Total concentration – 実際にサンプルがどれだけあったか、LIVEとDEAD両方の数値
・LIVE – パーセンテージと濃度
・DEAD – パーセンテージと濃度
★ 注意 [Trypan Blue dilution corrected]
トリパンブルーを入れなくてもセルカウントは可能ですが、機械が自動的に1:1で混ぜた状態として補正するので、使用しない場合は倍にする等の調整が必要になります。
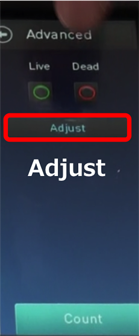
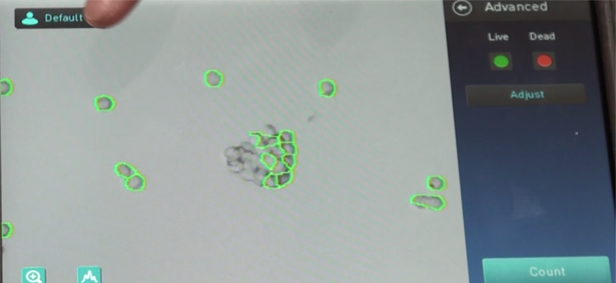
● 8. Moreを押すとAdvancedの画面になり、ゲーティングを行います。
① Live or Deadを押し、どの細胞をカウントしているのか確認します。
*トリパンブルーが取り込まれているものが死細胞、取り込まれていないものが生細胞としてカウントしています。
② Adjustを押します(Adjust画面になります)。
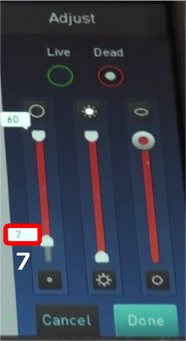
③ LiveとDeadの細胞サイズ、輝度、サーキュラリティの設定をします。
*輝度は最初に調整しているので、不十分な場合のみ変更します。
・細胞サイズが0だと小さいゴミをカウントしてしまうので、細胞サイズの最低値を7にします(LiveとDead)。
・”Done”を押すとデータが反映されます。
*機器の仕様として、細胞の測定可能サイズが7~60µmなので基本的は7としますが、具体的に細胞サイズが分かっている場合は変更しても構いません(±5µm程度にすると、より精度が上がります)。
*ゲーティングの情報はスライドの出し入れをしても残ります(電源が切れるまで)。
*逆に、元に戻したい場合は「Profile画面」のDefaultをLoadします。
④ Advanceの左矢印を押すとResult画面に戻るので、反映された結果が確認できます。
★ 注意 [計測について]
計測範囲は通常、血球計側盤では4×4のマス目を計測しますが、Countessでは3.5個分のマス目を計測しています(ほぼ血球計測盤と同じハンドリングになります)。
● 9. ヒストグラム(Focusがあった場所)が出るので確認を行います。
・DeadとLiveがどれぐらいの量で分布しているのか(どれをDead or Liveとしてカウントしたか)を確認します。
・白色の部分はゲーティングで省いた領域を指します。
・ゲーティングの方法には実際の細胞を見ながら確認する方法と、ヒストグラムを見ながら確認する方法の2通りがあります。
★ 注意
Zoomして実際の細胞を見ながらゲーティングすると、より漏れが少なくなります。
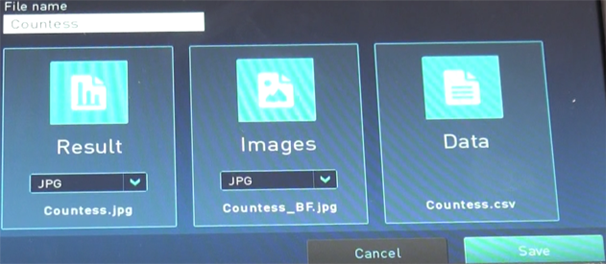
● 10. Saveを押すと保存の設定画面に移ります。
・Result, Image, Dataの必要な部分を押すと選択できます(不必要なものは選択しなくても問題ありません)。
・Result – Resultの画面
Image – 画像(写真)のみ *保存形式にはjpeg, bmp, png, tiffがあります。
Data – csvファイルで抽出(細胞のaverage size、total concentration等)
・File nameも変更が可能です。
・USBメモリを刺し、Saveを押すとデータが保存されます。
*データの保存は1つ計測したら保存し、次の計測をしたら再度保存するようにします。
・データは以下のようにエクセルで確認できます。
● Tips 1. [Trypan Blue stain 0.4%]
・純正のものを小分けして、施設で分譲しています。分譲は現在中止しています。
・0.4%で使用します。
*機械のキャリブレーションをこれで行っているので、濃い濃度だと正確に計測できない可能性があります。
・ディスポーザブルスライド購入時に1本付属しています。
・長く置くと成分が凝集することがありますが、使用前に温めて混ぜれば問題ありません。
・1mL入りで5µずつ使用するので、500回使用できます。
● Tips 2. [サンプルの調製]
・ボルテックスで撹拌しても問題ありません。
・ディッシュで接着しているものであれば、そのまま剥がして計測します。
・PBSは必要に応じてウオッシュして構いません(懸濁液はPBSのほうが透明なのでお勧めです)。
・トリパンブルーとの混合液(1:1 10µl)は表面張力でスライドガラス内に自動で入っていきます。
・使用していない側は後日使用することも可能です。
・画像解析の限界として、凝集している細胞はある程度アルゴリズムを持って差別化できますが、輪郭がぼやけたものは判断するのが難しくなります。
・注意点として剥がす際に凝集しないよう、しっかりとタッピングすると若干改善されます。












Leave a Reply